【编者按】
欧盟新规将美容产品纳入监管视野,填补了长期存在的法律空白。从彩色隐形眼镜到皮肤填充剂,这些看似与医疗无关的产品实则潜藏风险。编者提醒,消费者需警惕”非医疗用途”不等于”低风险”的认知误区,相关企业更应主动适应监管升级,共同筑牢安全防线。
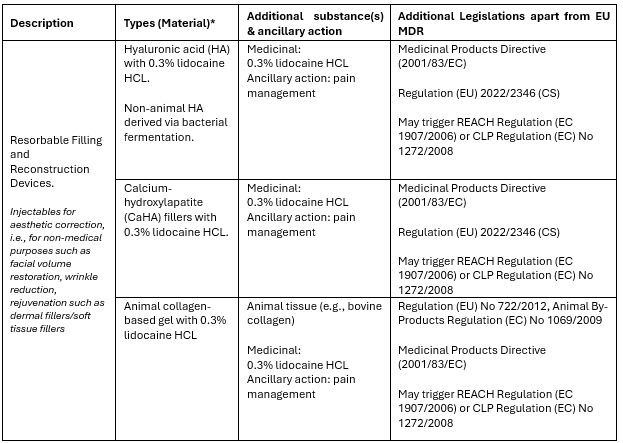
与之前的指令90/385/EEC(有源植入式医疗器械指令)和93/42/EEC(医疗器械指令)相比,法规(EU) 2017/745(医疗器械法规[MDR])引入的一项重大变化是包含了无预期医疗用途的产品,如欧盟MDR附件XVI所列(参见下表1)。这一补充旨在弥补无预期医疗用途但与医疗器械具有相似风险状况产品的监管空白。这些包括彩色隐形眼镜或皮肤填充剂等美容和生活方式产品,这些产品已对使用者造成严重伤害。
用于美容程序的附件XVI产品可能包含药用物质(例如盐酸利多卡因)、动物组织(例如牛胶原蛋白)或动物来源物质(禽类透明质酸),或者可能包括源自人血的物质(自体)的治疗。
除了考虑额外的立法外,无预期医疗用途产品的制造商还必须应用一套针对其附件XVI组的统一风险管理和临床评估要求。这些在法规(EU) 2022/2346中定义,该法规设定了通用规范(CS),提供了进一步的产品特定和具有法律约束力的标准。
除了通用规范外,此类产品的制造商必须在考虑以下多个指导文件的基础上,仔细应对各种监管交叉点:
– 医疗器械与其他类型产品之间的区分及其分类
– 咨询程序及其文件编制
– 关于编制结构良好的通用技术文件(CTD)的若干ICH指南
范围扩展到无预期医疗用途的产品(第1条第2款和第3款)反映了对与某些功能和医疗器械类似的美容和化妆品相关的风险日益增长的担忧。它为所有利益相关者强调了一些关键原则,例如:
借鉴医疗器械经验:即使产品仅用于美容目的,制造商和公告机构也必须考虑用于类似医疗器械产品的最先进实践和统一标准。
临床研究:在欧盟进行的涉及无预期医疗用途产品的任何临床研究必须满足欧盟MDR为医疗器械定义的相同监管和临床要求。
双重用途产品:某些产品同时具有医疗和非医疗预期用途。一个例子是皮肤填充剂,它可用于美容面部增强,也可用于治疗与HIV相关的面部脂肪萎缩。对于这些产品,制造商必须同时遵守两套要求——医疗器械的要求和无预期医疗用途产品的要求。
引入附件XVI产品通用规范的法规(EU) 2022/2346标志着重要里程碑,于2023年6月生效,并规定了如何将欧盟MDR附件I下的一般安全和性能要求中规定的风险管理应用于这些产品。这使得公告机构能够为附件XVI中的这些产品颁发证书。
例如,通用规范的附件IV为皮肤填充剂制造商设定了具体要求,以证明他们如何解决:
– 与产品主要物质、透明质酸及其来源相关的固有风险
– 最终材料(凝胶)特性,如流变性、交联度和生物相容性